2017年仿制药注册申请量同比继续下滑正大天晴在2017年有12个仿制药获CDE承办盐酸莫西沙星成仿制热门,申报企业有10家有三个按新注册分类申报的仿制药获批。
2017年是各项药品审评审批政策全面实施的第一年,仿制药注册分类的重新定义、一致性评价工作的开展等,都对国内仿制药质量和疗效的提高有着重要意义。在各项政策的持续影响下,2018年仿制药审评审批要求愈加严格,企业在提出仿制药申请前需更加谨慎。
化学药品新注册分类的出台重新定义了我国仿制药的审批标准,从过去与原研药品质量一致到现在与原研药品质量和疗效均需一致,仿制药审评获批难度大幅提高。在一致性评价的冲击下,2017年国内仿制药申请量进一步下滑。从注册分类来看,2017年CDE承办的仿制药多为3类和4类,新注册分类的过渡初步完成。
图1:2015年-2017年CDE承办仿制药申请情况(按受理号计)
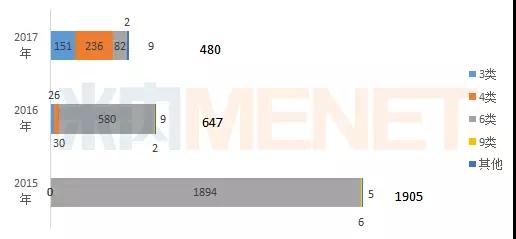
(来源:米内网MED药品审评数据库2.0,下同)
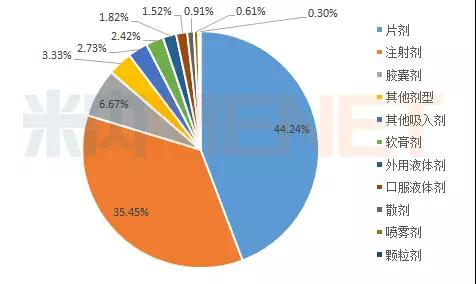
2017年仿制申请以片剂和注射剂为主,其中片剂占比最大。
图2:2017年CDE承办仿制药剂型分布情况
据米内网MED药品审评数据库2.0统计,2017年正大天晴有12个仿制药进入CDE,恒瑞医药和齐鲁制药均有10个,而科伦药业和浙江华海药业均有9个。
图3:2017年申报仿制药的企业情况(按通用名计)
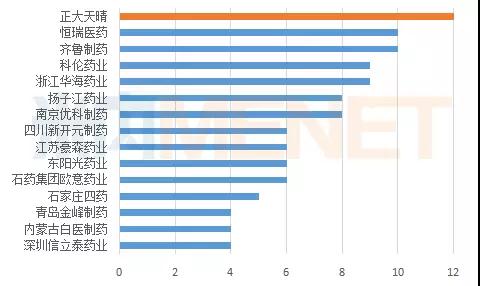
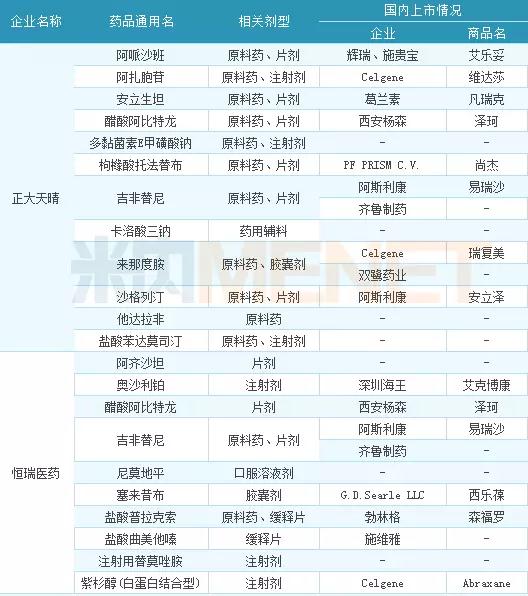
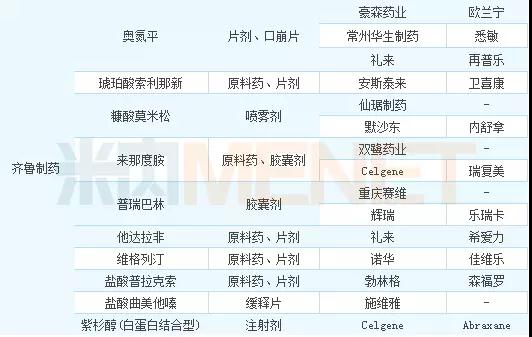
表1:2017年仿制申请品种数前三位企业品种情况
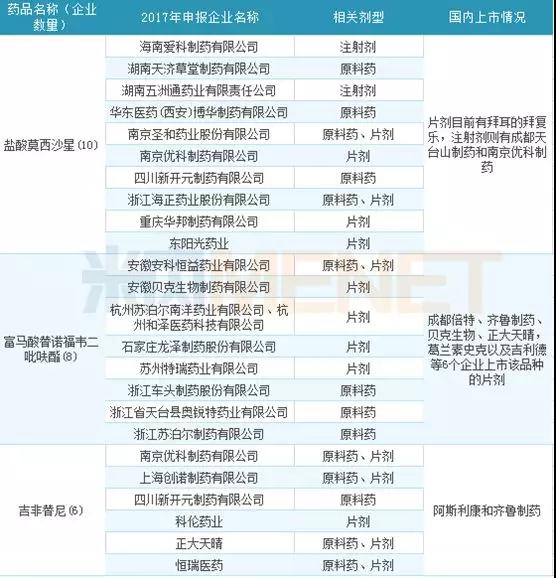
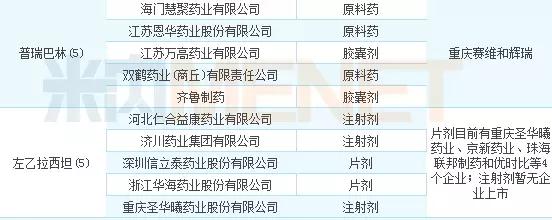
2017年申报企业数在5家以上的品种有5个,分别是盐酸莫西沙星、富马酸替诺福韦二吡呋酯、吉非替尼、普瑞巴林以及左乙拉西坦。其中申报盐酸莫西沙星的企业有10家,竞争十分激烈。
图4:2017年各个品种申报情况(按企业数排名)
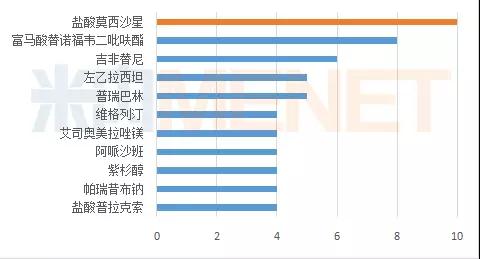
表2:2017年仿制药申请热门品种
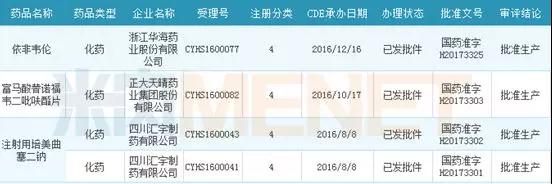
截至2017年底,有三个按新注册分类申报的仿制药获批生产,分别是浙江华海药业的依非韦伦原料、正大天晴的富马酸替诺福韦二吡呋酯片以及四川汇宇制药的注射用培美曲塞二钠。
表3:2017年按新注册分类获批的仿制药
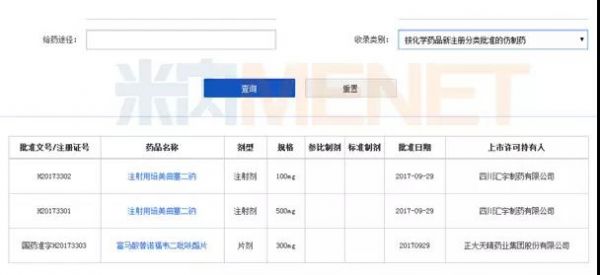
值得一提的是,按照CFDA在2016年发布的106号文《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告中的相关说明:按照《关于发布化学药品注册分类改革工作方案的公告》(CFDA2016年第51号)的有关要求申报仿制药注册申请,由药审中心审评,批准上市后视为通过一致性评价,可享有通过一致性评价的相关政策支持,而获批的药品制剂将收录至《中国上市药品目录》中的“按化学药品新注册分类批准的仿制药”类别。
图5:《中国上市药品目录》中的“按化学药品新注册分类批准的仿制药”类别收录的品种



 找产品
找产品
 招代理商
招代理商 找工作
找工作 查数据
查数据