齐鲁、扬子江、科伦实力领衔!六大机会仿制药企应重视!
2022年1月30日,《“十四五”医药工业发展规划》发布,数据显示,“十三五”期间,278个品种964件通过仿制药质量和疗效一致性评价。
对于这个规划,业界解读为“迎来创新药时代”。那么,仿制药又该何去何从?“十四五”定调之下,仿制药立项机会在哪里?
行业竞争格局
化学药分类改革带来两大仿制药机会
2015年启动的化学药注册分类改革,对业界影响最深的一个机会是仿制药重新洗牌的机会:其一,对于没有仿制药上市的专利过期原研产品,首仿药上市后与专利过期原研药享受同样价格待遇,有望切分专利过期原研药产品的市场机会;其二,专利过期原研药培养好的市场,国内的新旧玩家只要通过一致性评价(含视同)就有机会瓜分。
说到底,化学药仿制药一致性评价提倡的是新进入玩家瓜分原有存量市场的机会。
集采规则上线,机会“变现”增三个条件
2019年开始,集采规则上线。企业在不知道招标规则下的前期投入终于有了结果——越多厂家投入的产品,价格竞争越激烈、价格越低。
此前提到的两个机会的“变现”还必须有三个条件:1)产品进入集采;2)生产企业的产品要在集采报名截止前获批;3)产品的成本要足够低,低到能中标还要有利润。
这意味着,仿制药的研发实力强、能够在集采报名截止前获批、且生产成本管控良好的企业,才有可能赢得机会——但是,能否赢得利润,则需要看中标价格和所获得的市场规模。
仿制药实力企业TOP10分布
笔者整理了前五批集采中标企业的产品清单,以国家集采中标产品数作为仿制药研发实力强且生产成本管控良好的判断标准,中标产品数越多,说明仿制药研发和生产实力越强。排名前十的国内仿制药企业分别是齐鲁制药、扬子江、科伦药业、正大天晴、石药集团、江苏豪森、复星医药、江苏恒瑞、华海药业和倍特药业。
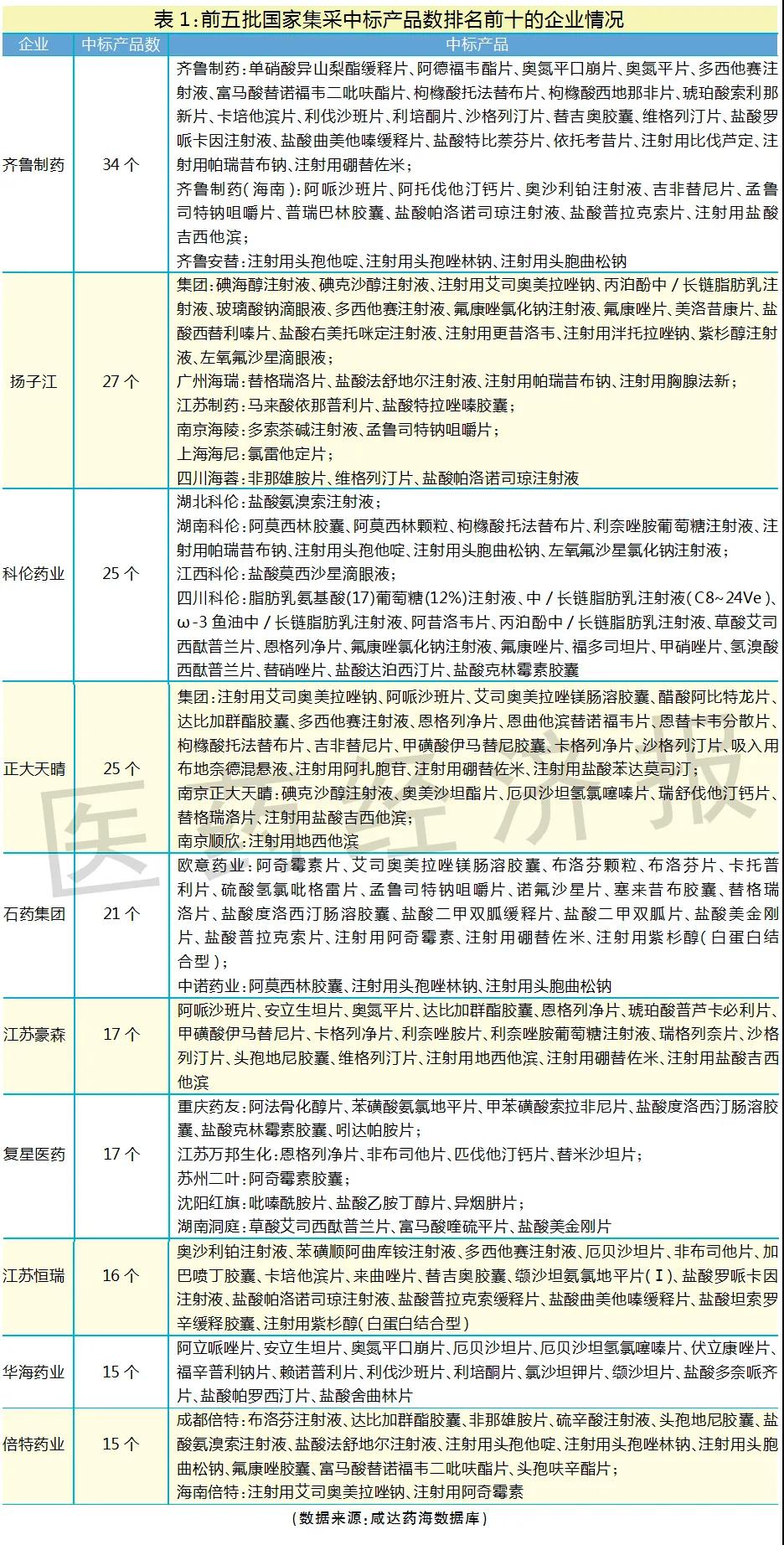
排名前十的国内仿制药企业的集团总部主要来自河北、山东、江苏、上海、浙江和四川,暂无集团总部在北京、广东的企业挤进前十。广东表现最好的企业是东阳光,共11个产品国家集采中标。
“十四五”引擎
哪些区域潜力巨大?
根据“十四五”规划目标,落实京津冀协同发展、长江经济带发展、粤港澳大湾区建设、长三角一体化发展等国家重大战略,促进医药产业在全国范围内合理布局和有序转移。目前仿制药基础较好的还是长三角,其他区域的仿制药仍有很大发展潜力。
哪十个重点支持城市?
“十四五”规划希望重点支持 10个左右医药创新基础好、科技资源集中的城市,对接国际创新资源,吸引创新型企业集聚,发展成为产业新动能的主要引擎。发挥创新高地的技术溢出效应,带动周边区域协同发展,形成区域资源互补、产业链深度融合的高水平医药产业集聚区。
北京、广州和深圳能否成为10个城市之一?广东的城市是否更愿意投入医疗器械?这些城市原有的药品生产资源是否可以考虑和当地的器械共同发展药械组合产品?药械组合产品属于“十四五”医药规划的化学药技术攻关工程所涵括的范围。
目标?短板领域?
经济全球化遭遇逆流,产业链供应链加快重塑,目前我国医药制造大中小企业协同发展的产业生态尚未形成,产业集中度不高——2020年百强企业营业收入比重超过30%。供应保障方面,应对重大公共卫生事件的能力需增强,企业开发罕见病药、儿童药积极性低,小品种药仍存在供应风险。制造水平方面,仿制药、辅料、包材等领域质量控制水平仍需提高,原料药绿色生产和布局问题仍需解决。
“十四五”规划期望到2025年,产业链供应链稳定可控:医药制造规模化体系化优势进一步巩固,一批产业化关键共性技术取得突破,重点领域补短板取得积极成效,培育形成一批在细分领域具有产业生态主导带动能力的重点企业;供应保障能力持续增强:重大疾病防治药品、防护物资和诊疗设备供应充足,医药储备体系得到健全;基本药物、小品种药、易短缺药品供应稳定,一批临床急需的儿童药、罕见病药保障能力增强;制造水平系统提升:药品全生命周期质量管理得到加强,通过一致性评价的仿制药数量进一步增加;企业绿色化、数字化、智能化发展水平明显提高,安全技术和管理水平有效提升,生产安全风险管控能力显著增强。
六大立项机会
对于国内仿制药企业来说,机会可能来自以下6个方面:
01、可能不集采的产品——短缺药
基本药物、儿童药品、急抢救药品的短缺药可能会纳入挂网采购,企业可以考虑国家短缺药品清单和临床必需易短缺药品重点监测清单上的产品。
02、《鼓励仿制药品目录》上临床需求未被满足的专利到期药物
这类产品的仿制开发需要注意:如果仿制厂家较多,就会面临集采。技术难度一般的项目仿制厂家数会较多,从而导致竞争加剧。
03、儿科院内制剂
根据企业自身的GMP生产条件承接儿科院内制剂生产的仿制药项目。这类项目目前主要是欠缺审批流程,而且所生产的产品只能在儿科院内销售,不能在院外销售。
04、不能启动一致性评价的剂型
鉴于目前只有口服固体制剂和注射剂启动一致性评价,不能启动一致性评价的产品批文不会受一致性评价影响,可以考虑批文转让家数较少、有市场潜力的产品。仿制不启动一致性评价的剂型有望抢夺原有厂家的市场,因为根据政策,3家通过一致性评价后,未通过一致性评价的厂家不能在医疗机构终端销售。
此外,“十四五”规划鼓励有条件的企业率先开展口服固体制剂、注射剂之外的其他剂型产品的一致性评价。但是,如果没有配套的技术指导文件,企业即便研究了,也非常可能面对与注射剂一样的情况,不被受理或者即便受理也不被审评审批。
05、只用小众辅料、包材的制剂
研发的制剂产品必须但只有进口的药用辅料、包装材料,才能满足仿制药一致性评价、制剂国际化等要求。
这类项目最大的难点是:如果是太小众的辅料和包材,市场规模不大,辅料和包材企业开发意愿不高,通常是在项目研发需求下推进辅料和包材的开发。
06、复杂制剂
复杂制剂具有高选择性、长效缓控释等特点,包括:微球等注射剂,缓控释、多颗粒系统等口服制剂,经皮、植入、吸入、口溶膜给药系统,药械组合产品等。
这些产品研制出来还是要面对集采,只是相比普通制剂,复杂制剂攻克的厂家相对较少。其中,缓控释剂型目前的集采数据显示,头部企业基本上都已攻克该技术,并且成本可控。
责任编辑:露儿
-
一批药被查 涉维C银翘片、阿胶…
一批药被查 涉维C银翘片、阿胶…...
-
高值耗材最高降价80% 涉雅培、波科、贝朗…
8月1日,云南省曲靖市举行高值医用耗材联盟带量集中采购第一批次中选产品企业签约仪式。...
-
国家指令 整治所有医院回扣 暗访组出发
日前,国家卫健委发布了《2020年医疗行业作风建设工作专项行动方案》,这次方案的重点就是规范医疗机构及其从业人员行为,印发给各省、自治区、直辖市及新疆生产建设兵团卫生健康委,开始组织实施。...
-
医药代表系统学习产品知识的十个步骤
每个刚入行的医药代表初期都会接受公司大量培训,产品知识培训更是重中之重,不仅培训而且还要考试。...
-
“3+6”医用耗材带量采购,价格信息公布
吉林省政府采购中心消息发布《京津冀及黑吉辽蒙晋鲁医用耗材(人工晶体类)联合带量采购文件(LH-HD2020-1)》(下称《采购文件》),公布人工晶体类耗材的具体采购品种、申报价格等信息。 ...
-
首轮价格降幅低于42% 医疗器械企业直接淘汰
首轮价格降幅低于42% 医疗器械企业直接淘汰...
-
Q1最惨淡的两大药品领域,代表都离职了!
中国虽然是世界上最先控制住疫情的国家,但随着全球疫情的爆发,输入病例不断上升,加上中国本土还有不少无症状感染患者,这使得中国经济无法完全恢复正常。...
-
某些药企又要开启新一轮裁员了
做代表难,今年更加难。除了国家级的带量采购,省级也有带量采购,感觉就像是夹缝中求生存。...
-
两家外企大裁员,患教专员全部解散!
两家外企大裁员,患教专员全部解散!...
-
执业药师挂证,面临终生逐出行业的巨大风险
执业药师挂证,面临终生逐出行业的巨大风险...
-
虚开发票2.5亿,涉多家药械企业(附目录)
近日,国家税务总局马鞍山市税务局发布的《重大税收违法案件信息公告2020年3月》显示,51家企业涉嫌虚开发票,其中24家是药械企业或相关资讯、服务企业。...
-
91家药企收入公开:以岭、科伦、康恩贝…
突如其来的新冠肺炎疫情,对中国的冲击力和冲击面都超过了2003年的非典,对中国经济乃至世界经济也产生了不可避免的影响,也严重扰乱了正常的经济运行节奏。...





















