56个药品被点名!正大天晴已突围 赛诺菲重磅新药被哄抢
近日,国家卫健委等六部门正式公布了《第二批鼓励仿制药品目录》,再有17个品种被纳入,截至目前,两批目录合共收录了50个品种(按通用名+剂型统计为56个产品)。据悉,被纳入的品种为国内专利即将到期但尚未提出注册申请、临床供应短缺或竞争不充分的药品,企业仿制相关药品可获得临床试验、关键共性技术研究、优先审评审批等方面支持。米内网数据显示,2019年国内仿制药终端销售额为10000多亿元,受带量采购和重点监控目录政策影响,仿制药的增速持续放缓,高端仿制药入局后有望激发市场新活力。
鼓励仿制出成效!正大天晴领军拿下“国内首家”
2019年6月《第一批鼓励仿制药品目录建议清单》发布,同年10月正式公布目录名单,最终利匹韦林片被剔除,33个品种成功入选。2020年12月《第二批鼓励仿制药品目录建议清单》发布,2021年3月正式公布名单,溴莫尼定噻吗洛尔滴眼剂以及奥拉帕利片被剔除,最终17个品种成功入选。
表1:鼓励仿制药品中已有国产批文的产品情况
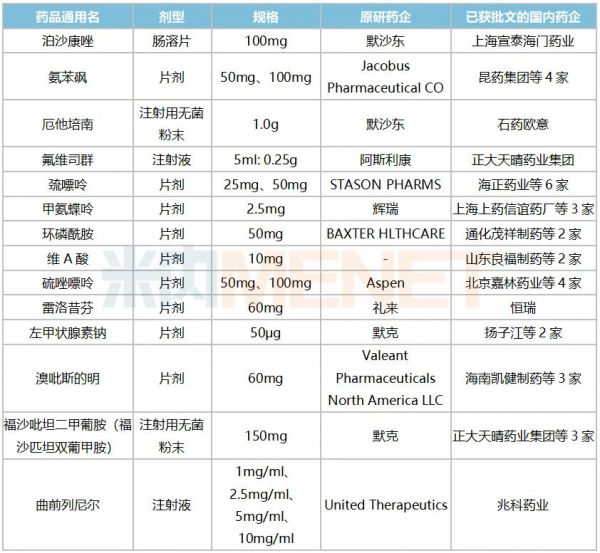
来源:米内网一键检索
据统计,鼓励仿制的56个药品中有14个已有国产批文,得益于政策鼓励,正大天晴药业集团、兆科药业、上海宣泰海门药业获得了优先审评的红利,产品火速获批上市。
米内网数据显示,正大天晴药业集团的注射用福沙匹坦双葡甲胺在2015年9月申报3.1类新药上市,2017年9月被纳入优先审评,理由为“专利到期前1年的药品生产申请”,2019年10月获批上市,成为该品种国内首家。随着豪森与齐鲁陆续获批,国内已有3家企业获得批文,山东罗欣药业集团的3类仿制上市申请已在审评审批中。
2020年,正大天晴药业集团拿下了阿斯利康的重磅注射剂氟维司群的国内首仿。原研产品2018年全球销售额接超过10亿美元,2019年在中国城市公立医院、县级公立医院、城市社区中心及乡镇卫生院(简称中国公立医疗机构)终端及中国城市实体药店终端合计销售额超过5亿元。正大天晴药业集团于2019年1月申报4类仿制上市,2020年4月被纳入优先审评,理由为“海外共线”,同年8月获批上市。目前豪森、杭州九源基因工程的4类仿制上市申请在审评审批中,在国产高端仿制药的冲击下,阿斯利康的市场份额岌岌可危。
默沙东的泊沙康唑2018年全球卖出了7.4亿美元,目前已进口国内的剂型有口服混悬液、肠溶片以及注射液。第一批鼓励仿制目录中,注射液以及肠溶片被纳入,上海宣泰海门药业于2019年2月提交泊沙康唑肠溶片4类仿制上市申请,同年9月被纳入优先审评,理由为“海外共线”,于2021年1月拿下国内首仿。四川科伦药业的泊沙康唑肠溶片4类仿制上市申请正在审评审批中,有望成为国内第二家。目前,默沙东的肠溶片在国内市场销售尚未放量,国产高端仿制有望抢先发力。
兆科药业的曲前列尼尔注射液于2018年12月申报4类仿制上市,2019年6月被纳入优先审评,理由为“罕见病用药”,2020年3月获批首仿。曲前列尼尔是一款人工合成前列环素药品,可以促进血管舒张,同时可抑制血小板的聚集,用于肺动脉高压的症状治疗,该产品半衰期长、药物结构稳定、使用方便,作为一线治疗和抢救药物应用广泛。
此外,氨苯砜、巯嘌呤、甲氨蝶呤、环磷酰胺等品种目前虽有国产批文,但尚无企业过评,鼓励企业研发并生产高端仿制药,有利于提高该品种整体质量水平。
10个首仿将来袭,恒瑞、奥赛康……要冲刺
表2:暂无国产批文但仿制上市在审的产品情况
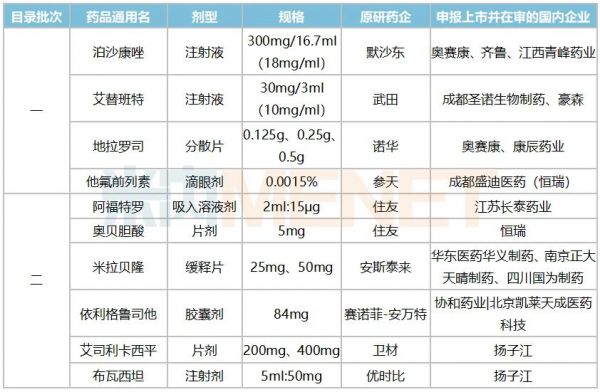
来源:米内网MED2.0中国药品审评数据库
鼓励仿制目录中有10个产品即将迎来国内首仿,默沙东、诺华、赛诺菲等跨国巨头独占国内市场的格局有望被打破。
前文提到,泊沙康唑是默沙东的重磅品种,注射液于2021年获批进口。奥赛康于2018年8月申报泊沙康唑注射液3类仿制上市申请,在2019年2月被纳入优先审评,理由为“专利到期前1年的药品生产申请”,目前受理号在审评审批中,无论从申报时间还是政策鼓励方面来看,奥赛康拿下国内首仿的概率最大。齐鲁与青峰药业分别在2020年9月、2021年1月申报3类仿制上市,目前在审评审批中;先声药业|杭州澳亚生物技术于2021年2月申报4类仿制上市,目前已获受理。
恒瑞子公司成都盛迪医药于2020年1月申报他氟前列素滴眼液4类仿制上市,同年5月被纳入优先审评,理由为“临床急需、市场短缺药品”。该产品是第一个不含防腐剂的前列腺素类似物滴眼液,临床上主要用于降低眼内压升高的患者开角型青光眼或高眼压症,现为全国医保目录谈判品种。
米拉贝隆缓释片被纳入了第二批鼓励仿制目录,原研药企安斯泰来2019年全球卖出1616亿日元(约为14.8亿美元),2017年获批进入国内市场,2020年谈判成功进入全国医保目录。华东医药集团华义制药于2019年10月申报4类仿制上市,2020年3月被纳入优先审评,理由为“专利到期前1年的药品生产申请”。目前,南京正大天晴制药和四川国为制药分别于2020年9月、2021年1月申报4类仿制上市的受理号正在审评审批中。
依利格鲁司他胶囊是赛诺菲-安万特的重磅孤儿药,2019年全球销售额达2.1亿欧元(约2.5亿美元),目前原研产品尚未获批进口。协和药业|北京凯莱天成医药科技于2019年4月申报3类仿制上市,随后被纳入优先审评,理由为“罕见病药品”,目前暂无其他企业申报上市。
赛诺菲、强生重磅产品遭哄抢,科伦、青峰……冲在最前线
表3:暂无国产批文、暂无企业申报上市但已有企业获批临床的产品
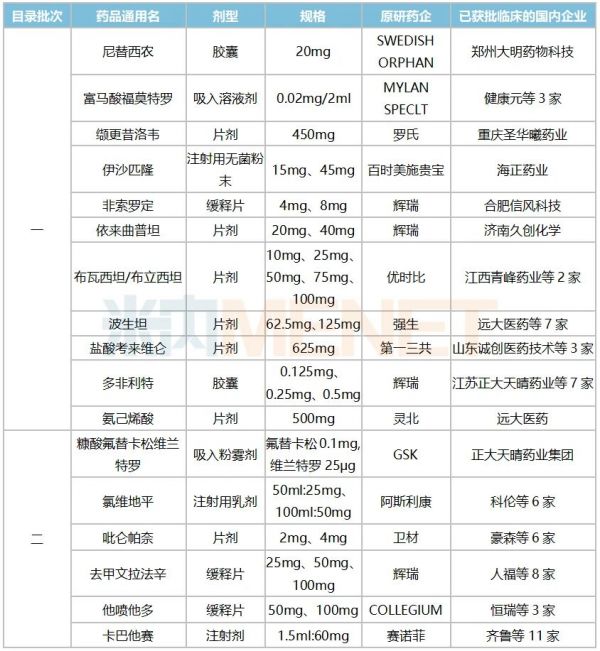
来源:米内网MED2.0中国药品审评数据库
鼓励仿制目录中还有32个产品目前暂无国产批文也无企业申报上市,这些产品有17个已有企业获批临床,其中赛诺菲的卡巴他赛、辉瑞的去甲文拉法辛、多非利特以及强生的波生坦最火热,获批临床的国内药企数量达7家以上。
卡巴他赛是新一代半合成的紫杉烷类药物,多项体内外研究显示其具有良好的抗肿瘤效果,赛诺菲于2010年获FDA批准上市,2018年全球销售额突破4亿欧元,2020年创出新高,达5.4亿欧元。
图1:科伦的卡巴他赛注射液最新临床进展

来源:米内网中国药品临床试验公示库
目前,国内共有11家药企申报了卡巴他赛注射液3.1类新药临床申请并已获批,四川科伦药物研究院最早于2015年拿到临床批件,目前最新进展是晚期实体瘤I期临床已完成,涉及胃癌或胃食管结合部腺癌的相关试验正在进行中。
强生的波生坦是一种特异性、竞争性的双重内皮素受体拮抗剂,可以通过降低肺和全身血管阻力,从而在不增加心率的情况下增加心脏输出量,改善特发性肺动脉高压(PAH)患者的运动能力和血流动力学指标,2001年被FDA批准在美国上市,2018年全球销售额超过5亿美元。原研药于2006年获批进入国内市场,目前获批进口的剂型有片剂和分散片,分别于2019年、2020年通过谈判成功进入全国医保目录,2019年在中国公立医疗机构终端及中国城市实体药店终端该品种合计销售额超过1亿元。
图2:浙江医药新昌制药厂的波生坦片最新临床进展

来源:米内网中国药品临床试验公示库
波生坦片被纳入第一批鼓励仿制目录,目前国内已有7家药企申报6类仿制上市获批临床,其中浙江医药新昌制药厂最早于2014年拿到临床批件,用于治疗WHO III级和IV级原发性肺高压病人的肺动脉高压或者硬皮病引起的肺高压的生物等效性试验已完成。
吡仑帕奈是卫材的抗癫痫新药,于2012年首次获得FDA批准用于12岁以上癫痫患者部分性发作的辅助治疗,无论患者是否伴有继发性全面发作,该品种2019年全球销售额已达253亿日元(约2.3亿美元)。原研药于2019年获批进入中国市场,2020年谈判成功进入全国医保目录。
图3:南京华威医药科技的吡仑帕奈片最新临床进展

来源:米内网中国药品临床试验公示库
目前,国内共有6家药企申报了吡仑帕奈片3.1类新药临床申请并已获批,南京华威医药科技于2016年拿到临床批件,目前最新进展是适用于4岁及以上部分性癫痫发作且伴有或不伴有继发性全身大发作的癫痫病患者的辅助治疗以及适用于12岁及以上癫痫患者原发性全面强直-阵挛癫痫发作的辅助治疗的生物等效性试验正在进行中。
优时比的布瓦西坦(布立西坦)于2016年先后获欧盟EMA及美国FDA批准上市,作为其他药物的附加治疗用于治疗16岁及以上癫痫患者的部分性发作,2019年全球销售额上涨至2.2亿欧元。
图4:布瓦西坦片的最新临床进展

来源:米内网中国药品临床试验公示库
江西青峰药业于2019年申报3类仿制上市获批临床,目前最新进展是癫痫部分性发作辅助治疗的生物等效性试验已完成,治疗4岁及以上患者的部分性发作癫痫III期临床正在进行中;杭州和泽医药科技|浙江京新药业于2020年9月申报3类仿制临床申请获批,目前最新进展是适用于治疗4岁以上部分发作性癫痫的生物等效性试验已完成。
结语
鼓励仿制药目录的出台与扩容,旨在鼓励更多的厂家去生产、竞争,压缩申报时间,优化申报途径,在一定程度上缓解临床必需、疗效确切、供应短缺药品的供应。其次,近年来仿制药一致性评价的开展,正改变着我国仿制药行业长期以来“小、乱、散”的局面,集采常态化之下,未来低壁垒仿制药份额会缓慢下降,高壁垒仿制药份额将逐渐提升。目前,两批次鼓励仿制药品目录中仍有15个产品暂无国内药企涉足,其中不乏罗氏、GSK、艾伯维、诺和诺德等跨国药企的最新产品,哪些国内药企在未来会主动出击?我们将继续跟踪观察。
来源:中国政府网、米内网数据库
审评数据统计截至3月19日,如有错漏,敬请指正。
责任编辑:露儿
-
一批药被查 涉维C银翘片、阿胶…
一批药被查 涉维C银翘片、阿胶…...
-
高值耗材最高降价80% 涉雅培、波科、贝朗…
8月1日,云南省曲靖市举行高值医用耗材联盟带量集中采购第一批次中选产品企业签约仪式。...
-
国家指令 整治所有医院回扣 暗访组出发
日前,国家卫健委发布了《2020年医疗行业作风建设工作专项行动方案》,这次方案的重点就是规范医疗机构及其从业人员行为,印发给各省、自治区、直辖市及新疆生产建设兵团卫生健康委,开始组织实施。...
-
医药代表系统学习产品知识的十个步骤
每个刚入行的医药代表初期都会接受公司大量培训,产品知识培训更是重中之重,不仅培训而且还要考试。...
-
“3+6”医用耗材带量采购,价格信息公布
吉林省政府采购中心消息发布《京津冀及黑吉辽蒙晋鲁医用耗材(人工晶体类)联合带量采购文件(LH-HD2020-1)》(下称《采购文件》),公布人工晶体类耗材的具体采购品种、申报价格等信息。 ...
-
首轮价格降幅低于42% 医疗器械企业直接淘汰
首轮价格降幅低于42% 医疗器械企业直接淘汰...
-
Q1最惨淡的两大药品领域,代表都离职了!
中国虽然是世界上最先控制住疫情的国家,但随着全球疫情的爆发,输入病例不断上升,加上中国本土还有不少无症状感染患者,这使得中国经济无法完全恢复正常。...
-
某些药企又要开启新一轮裁员了
做代表难,今年更加难。除了国家级的带量采购,省级也有带量采购,感觉就像是夹缝中求生存。...
-
两家外企大裁员,患教专员全部解散!
两家外企大裁员,患教专员全部解散!...
-
执业药师挂证,面临终生逐出行业的巨大风险
执业药师挂证,面临终生逐出行业的巨大风险...
-
虚开发票2.5亿,涉多家药械企业(附目录)
近日,国家税务总局马鞍山市税务局发布的《重大税收违法案件信息公告2020年3月》显示,51家企业涉嫌虚开发票,其中24家是药械企业或相关资讯、服务企业。...
-
91家药企收入公开:以岭、科伦、康恩贝…
突如其来的新冠肺炎疫情,对中国的冲击力和冲击面都超过了2003年的非典,对中国经济乃至世界经济也产生了不可避免的影响,也严重扰乱了正常的经济运行节奏。...





















