药监局通知:2021年,新一轮飞检全面开始
药监局下令,2021年医疗器械全面大检查开始
日前(3月15日),山西省药监局最新发布了一则关于印发山西省2021年医疗器械生产企业不良事件监测工作监督检查计划的通知。
通知中,山西省药监局联合各市场监督管理局、综改示范区市场监督管理局,省药物警戒中心,对2021年山西省内的医疗器械监督检查计划进行了公示。
按照工作计划中显示,2021年山西省内的医疗器械大检查将分为三大阶段,分别为自查阶段、检查阶段、总结阶段。
检查将采取飞行检查的抽查模式,对于抽查中发现不符合法规要求的将责令改正,并给予警告,拒不改正的按照法规要求予以处罚。
文件的发布也就意味着,2021年山西省新一轮医疗器械大检查即将开始。
4大项目、9大内容,重点检查
在山西省的医疗大检查中,3月15日-7月30日将作为第一个自查阶段,各市区对辖内第一类医疗器械生产企业进行自查,省局委托省药物警戒中心组织省内第二类及第三类医疗器械生产企业开展自查。
7月30日-9月20日将为检查阶段,局组织省药物警戒中心根据各类医疗器械生产企业自查情况和市级监测中心工作情况进行监督抽查。
飞检中重点抽查:1、无菌植入性高风险医疗器械及防疫物资生产企业;2、不认真落实医疗器械不良事件监测责任的企业。
9月20日-11月15日为总结阶段,省药物警戒中心必须于2021年12月10日前形成全省医疗器械不良事件监测工作汇总报告至山西省药监局处。
按照检查计划显示,2021年山西省的重点检查将围绕医疗器械生产企业进行。
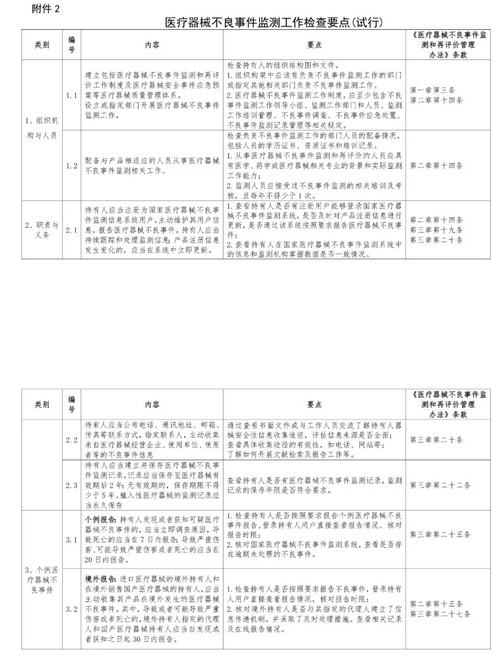
重点检查项目为:
1. 医疗器械生产企业在国家医疗器械不良事件监测信息系统用户资料注册填报情况;
2. 医疗器械生产企业评价和处置严重不良事件及风险信号情况;
3. 医疗器械生产企业按规定时限编写产品定期风险评价报告情况;
4.创新审批的医疗器械开展重点监测情况。
重点检查内容为:
1.是否在生产质量管理体系中规定医疗器械不良事件监测相关制度和人员。
2.是否组织或参加《医疗器械不良事件监测和再评价管理办法》相关法规培训。
3.是否在国家医疗器械不良事件监测信息系统注册、完善用户信息,用户信息中是否填写监测负责人和联系人信息和联系方式,人员变动后是否及时更新。
4.是否在国家医疗器械不良事件监测信息系统登记全部产品注册(备案)信息,新取得的注册(备案)证书是否在30日内完成录入工作。
5.是否按照规定时限分析、评价严重和死亡的医疗器械不良事件报告。
6.是否对医疗器械风险信号开展风险评价并撰写风险评价报告,及时采取风险控制措施。
7.是否按照规定时限要求撰写并向省药物警戒中心提交产品定期风险评价报告。
8.是否按照要求妥善保存不良事件监测工作相关记录和资料。
9.是否按要求对创新审批的医疗器械在首个注册周期开展重点监测、撰写并提交重点监测工作方案、重点监测报告和工作总结。
文件最后,山西省药监局特别强调,为了做好监督抽查工作,省药监局将从各市市场监督管理局、综改示范区市场监督管理局各抽调2名熟悉医疗器械不良事件监测工作的专职人员参与检查工作。
一经发现有企业采取的控制措施不足以有效防范风险的,采取发布警示信息、暂停生产销售和使用、责令召回、要求其修改说明书和标签等监管措施。
全流程监管持续强化,监管治理组合拳出击
早在2020年4月,国家药监局发布的《关于发布医疗器械注册人开展不良事件监测工作指南》中就明确指出,未来要加强对医疗器械注册人、备案人的指导、监管力度,及时、有效控制医疗器械上市后风险。
不仅如此,此前国家药监局医疗器械监督管理司司长王者雄还表示,2021年监管部门将从落实企业主体责任、加强监督检查、组织开展监督抽检、做好出口产品质量监管四方面入手,全力做好疫情防控医疗器械质量监管。
在检查中,国家药监局将重点组织对无菌植入性医疗器械、国家集中带量采购医疗器械、创新医疗器械、附条件审批医疗器械等产品,以及多次抽检不合格医疗器械、投诉举报和舆情频发涉及质量问题等产品开展飞行检查。
与此同时,2021年国家药监局还将加大案件查办力度,严厉打击无证生产和生产无证产品、不符合强制性标准或产品技术要求等违法违规行为。
“今年,国家药监局将组织对风险高、使用量大、社会关注度高、日常监管工作发现存在问题的60余个品种开展国抽,对国家集中带量采购中选冠脉支架产品开展专项抽检。”
据不完全统计显示,2021年,国家药监局共有35家医疗器械企业因飞检不合格被公开通报,企业缺陷最高达112项。
按照此前正式通过的《医疗器械监督管理条例(修订草案)》规定,医疗器械生产企业中,涉及生产、经营假冒医疗器械的;未经生产许可从事第二类、第三类医疗器械生产活动的;未经经营许可从事第三类医疗器械经营活动的,被处罚金额直接上调至30倍,情节严重的,还将直接被吊销医疗器械注册证、医疗器械生产许可证或者医疗器械经营许可证。
涉嫌经营、使用无合格证明文件、过期、失效、淘汰的医疗器械,拒绝或者妨碍药监部门检查等医疗器械违法行为,最高将被处以货值金额10倍罚款,且直接责任人5年内不得从事医疗器械生产经营活动。
与此同时,文件中还强调,以上违法行为情节严重造成严重后果的,除了吊销相关责任人员的许可证之外,直接负责人员10年内将不得申请医疗器械许可或者从事医疗器械生产经营活动。构成犯罪、被判处有期徒刑以上刑罚的,终身不得申请医疗器械许可或者从事医疗器械生产经营活动。
此前2月中旬,辽宁省药监局也印发了《辽宁省药品监督管理局2021年度监督检查计划》,计划对医疗器械生产企业、进口医疗器械代理人以及医疗器械网络交易服务第三方平台进行新一轮全面检查。检查计划于2021年11月底前全部完成,检查方式以飞行检查为主。
显然,现阶段已经有越来越多的省市开始着手布局2021年医疗器械大检查工作,从工作的形式来看,目前仍以飞检为主。
需要提醒的是,在以往各个省市乃至国家的飞检中,往往会有多家医疗器械公司被突然袭击后遭到处罚,轻则罚款,重则直接停产整改。对于医疗器械企业而言,如何顺利遇检过检,无疑只有自查整改规范自身。



责任编辑:露儿
-
一批药被查 涉维C银翘片、阿胶…
一批药被查 涉维C银翘片、阿胶…...
-
高值耗材最高降价80% 涉雅培、波科、贝朗…
8月1日,云南省曲靖市举行高值医用耗材联盟带量集中采购第一批次中选产品企业签约仪式。...
-
国家指令 整治所有医院回扣 暗访组出发
日前,国家卫健委发布了《2020年医疗行业作风建设工作专项行动方案》,这次方案的重点就是规范医疗机构及其从业人员行为,印发给各省、自治区、直辖市及新疆生产建设兵团卫生健康委,开始组织实施。...
-
医药代表系统学习产品知识的十个步骤
每个刚入行的医药代表初期都会接受公司大量培训,产品知识培训更是重中之重,不仅培训而且还要考试。...
-
“3+6”医用耗材带量采购,价格信息公布
吉林省政府采购中心消息发布《京津冀及黑吉辽蒙晋鲁医用耗材(人工晶体类)联合带量采购文件(LH-HD2020-1)》(下称《采购文件》),公布人工晶体类耗材的具体采购品种、申报价格等信息。 ...
-
首轮价格降幅低于42% 医疗器械企业直接淘汰
首轮价格降幅低于42% 医疗器械企业直接淘汰...
-
Q1最惨淡的两大药品领域,代表都离职了!
中国虽然是世界上最先控制住疫情的国家,但随着全球疫情的爆发,输入病例不断上升,加上中国本土还有不少无症状感染患者,这使得中国经济无法完全恢复正常。...
-
某些药企又要开启新一轮裁员了
做代表难,今年更加难。除了国家级的带量采购,省级也有带量采购,感觉就像是夹缝中求生存。...
-
两家外企大裁员,患教专员全部解散!
两家外企大裁员,患教专员全部解散!...
-
执业药师挂证,面临终生逐出行业的巨大风险
执业药师挂证,面临终生逐出行业的巨大风险...
-
虚开发票2.5亿,涉多家药械企业(附目录)
近日,国家税务总局马鞍山市税务局发布的《重大税收违法案件信息公告2020年3月》显示,51家企业涉嫌虚开发票,其中24家是药械企业或相关资讯、服务企业。...
-
91家药企收入公开:以岭、科伦、康恩贝…
突如其来的新冠肺炎疫情,对中国的冲击力和冲击面都超过了2003年的非典,对中国经济乃至世界经济也产生了不可避免的影响,也严重扰乱了正常的经济运行节奏。...





















