创新药海外上市去哪儿?欧美日新药上市速度大PK
欧盟药品管理局(EMA)、美国食品药品监督管理局(FDA)与日本药品和医疗器械机构(PMDA)是国际上三个重要的药品监管机构。那么,对于要向海外布局创新药企业来说,去哪里寻求创新药上市更快呢?
在过去的5年(2014-2018年),药品监管环境的不断改善与跨国制药企业的战略变化,缩短了欧美日新药上市的时间,并增加了上市新药的数量。除此之外,影响欧美日新药上市速度的潜在因素还包括药品类型、治疗领域、审批方式、孤儿药资格等。
总体速度:美国最快,欧洲最慢
各个监管机构批准的新活性物质(New Active Substance,NAS)数量之间的年度差异,可以由许多因素来解释,例如申请人根据公司规模、医疗需求未满足的程度以及监管机构审批的速度,制定不同的新药申请提交策略。另一个因素是审批时间,某些机构,如FDA,全年不断批准NAS;而其他机构则在一年中的特定时间分批批准,如PMDA。
2018年,FDA批准60个NAS,数量最多;而EMA和PMDA分别批准40个、32个。2014-2018年,FDA、EMA和PMDA批准NAS的年均数量分别为46个、34个和37个。相比于2009-2013年,2014-2018年批准NAS的总量,FDA增长了54%,增幅最高;EMA和PMDA的这个增幅分别为48%和27%。
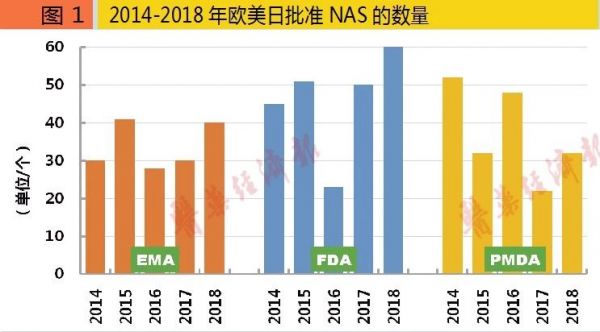
审批时间是指新药申请递交至批准所需的时间,包括监管机构与企业的用时;EMA的审评时间包括欧盟委员会(European Commission)的决策用时。 2018年,FDA批准NAS的中位时间为244日,用时最短;而EMA和PMDA分别为436日和323日。2014-2018年欧美日NAS的年均审批时间,FDA约为303日,PMDA约为311日;而EMA约为422日,是审批速度最慢的。

FDA的审批速度最快,可能是由于广泛采用了促进监管的路径(Facilitated Regulatory Pathways,FRPs),如优先审查(Priority Review)、突破性疗法(Breakthrough Therapy)、加速批准(Accelerated Approval)与快速通道(Fast Track)等。据统计,2018年FDA批准的NAS中,42%获得快速通道资格,25%被认定为突破性疗法。
化学药美国最快,生物药欧洲最快
2018年批准的NAS中,FDA批准化学药41个、生物制品19个;EMA批准化学药16个、生物制品24个;PMDA批准化学药18个、生物制品14个。2014-2018年欧美日批准的NAS中,化学药占比各约为58%、67%与72%,可见还是以化学药为主。
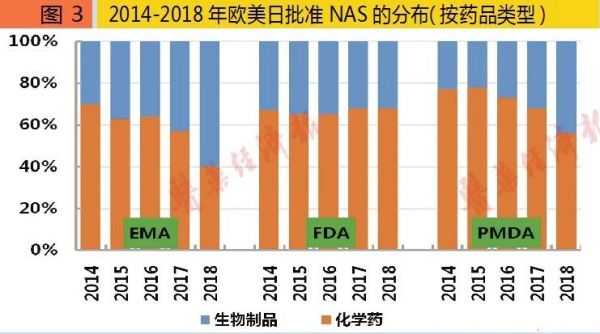
2018年,FDA批准的NAS中,化学药所需时间243日,生物制品所需时间308日;EMA批准化学药需447日、生物制品需436日;PMDA批准化学药需301日、生物制品需332日。2014-2018年欧美日批准NAS的年均所需时间,FDA是化学药快于生物制品,PMDA是生物制品与化学药基本持平,而EMA则是生物制品快于化学药。

肿瘤药、免疫药:首选美国,欧洲很慢
2018年,FDA批准的NAS中,抗肿瘤与免疫调节剂20个,其他治疗领域40个;EMA为抗肿瘤与免疫调节剂14个,其他治疗领域26个;PMDA为抗肿瘤与免疫调节剂11个,其他治疗领域21个。2014-2018年欧美日批准的NAS中,抗肿瘤与免疫调节剂占比各约为38%、33%与34%。
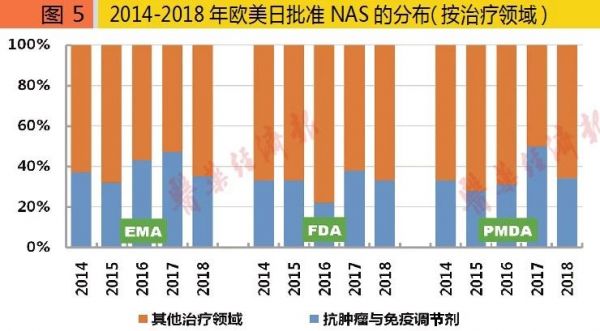
2018年,FDA批准的NAS中,抗肿瘤与免疫调节剂所需时间245日,其他治疗领域所需时间243日;EMA抗肿瘤与免疫调节剂所需时间465日,其他治疗领域所需时间436日;PMDA抗肿瘤与免疫调节剂所需时间306日,其他治疗领域需332日。2014-2018年欧美日批准的NAS的年均所需时间,FDA与PMDA均是抗肿瘤与免疫调节剂快于其他治疗领域;而EMA则是其他治疗领域略快于抗肿瘤与免疫调节剂。

加速审批:欧美日速度趋同
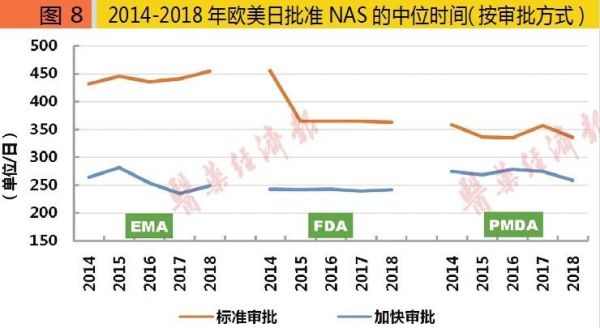
2018年,FDA批准的NAS中,加速审批44个、标准审批16个;EMA加速审批4个、标准审批36个;PMDA加速审批9个、标准审批23个。2014-2018年欧美日批准的NAS中,加速审批占比各约为15%、63%与43%,相比2009-2013年的7%、42%与25%,均有一定增长。

2018年,FDA批准的NAS中,加速审批所需时间242日,标准审批所需时间363日;EMA加速审批249日、标准审批455日;PMDA加速审批259日、标准审批336日。2014-2018年欧美日批准的NAS中,加速审批年均所需时间比标准审批各自快约185日、141日与73日。
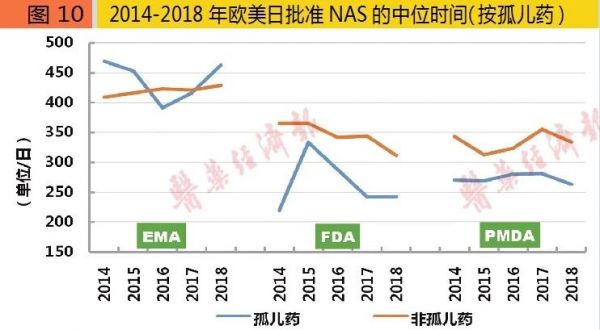
孤儿药:选择美日,欧洲没赚头
2018年,FDA批准的NAS中,孤儿药35个、非孤儿药25个;EMA孤儿药17个、非孤儿药23个;PMDA孤儿药8个、非孤儿药24个。2014-2018年欧美日批准的NAS中,孤儿药占比各约为39%、49%与34%。

2018年,FDA批准的NAS中,孤儿药所需时间243日、非孤儿药所需时间311日;EMA孤儿药所需时间463日、非孤儿药所需时间429日;PMDA孤儿药所需时间263日、非孤儿药所需时间334日。2014-2018年欧美日批准NAS的年均所需时间,FDA与PMDA均是孤儿药明显快于非孤儿药;而EMA则是孤儿药与非孤儿药基本持平。
首先上市地区:偏好美国,其次欧日
2018年,FDA批准的NAS中,首次批准或ICH区域内其他机构首次批准1个月之内的批准(以下简称“首次批准或1个月之内批准”)占75%,ICH区域内其他机构首次批准1个月之后的批准(以下简称“1个月之后批准”)占25%。EMA首次批准或1个月之内批准占20%、1个月之后批准占80%;PMDA首次批准或1个月之内批准占31%、1个月之后批准占69%。2014-2018年欧美日批准的NAS中,首次批准或1个月之内批准年均占比各约为30%、82%与27%。

责任编辑:露儿
-
一批药被查 涉维C银翘片、阿胶…
一批药被查 涉维C银翘片、阿胶…...
-
高值耗材最高降价80% 涉雅培、波科、贝朗…
8月1日,云南省曲靖市举行高值医用耗材联盟带量集中采购第一批次中选产品企业签约仪式。...
-
国家指令 整治所有医院回扣 暗访组出发
日前,国家卫健委发布了《2020年医疗行业作风建设工作专项行动方案》,这次方案的重点就是规范医疗机构及其从业人员行为,印发给各省、自治区、直辖市及新疆生产建设兵团卫生健康委,开始组织实施。...
-
医药代表系统学习产品知识的十个步骤
每个刚入行的医药代表初期都会接受公司大量培训,产品知识培训更是重中之重,不仅培训而且还要考试。...
-
“3+6”医用耗材带量采购,价格信息公布
吉林省政府采购中心消息发布《京津冀及黑吉辽蒙晋鲁医用耗材(人工晶体类)联合带量采购文件(LH-HD2020-1)》(下称《采购文件》),公布人工晶体类耗材的具体采购品种、申报价格等信息。 ...
-
首轮价格降幅低于42% 医疗器械企业直接淘汰
首轮价格降幅低于42% 医疗器械企业直接淘汰...
-
Q1最惨淡的两大药品领域,代表都离职了!
中国虽然是世界上最先控制住疫情的国家,但随着全球疫情的爆发,输入病例不断上升,加上中国本土还有不少无症状感染患者,这使得中国经济无法完全恢复正常。...
-
某些药企又要开启新一轮裁员了
做代表难,今年更加难。除了国家级的带量采购,省级也有带量采购,感觉就像是夹缝中求生存。...
-
两家外企大裁员,患教专员全部解散!
两家外企大裁员,患教专员全部解散!...
-
执业药师挂证,面临终生逐出行业的巨大风险
执业药师挂证,面临终生逐出行业的巨大风险...
-
虚开发票2.5亿,涉多家药械企业(附目录)
近日,国家税务总局马鞍山市税务局发布的《重大税收违法案件信息公告2020年3月》显示,51家企业涉嫌虚开发票,其中24家是药械企业或相关资讯、服务企业。...
-
91家药企收入公开:以岭、科伦、康恩贝…
突如其来的新冠肺炎疫情,对中国的冲击力和冲击面都超过了2003年的非典,对中国经济乃至世界经济也产生了不可避免的影响,也严重扰乱了正常的经济运行节奏。...





















