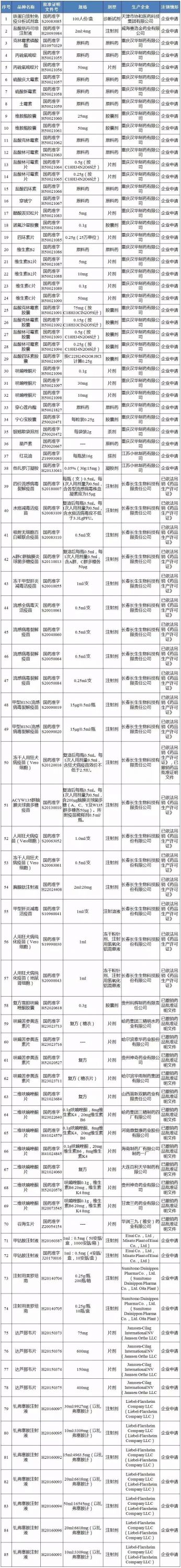
大批药品批文消失,不少是企业主动申请
核心提示:4月4日,国家药监局官网发布《关于注销铁蛋白放射免疫分析试剂盒等85个药品批准文号的公告》(以下简称《公告》)。
大批药品批文消失,不少是企业主动申请。
4月4日,国家药监局官网发布《关于注销铁蛋白放射免疫分析试剂盒等85个药品批准文号的公告》(以下简称《公告》)。
53个药企业主动申请注销批文
据《公告》,共85个药品注销批准文号,其中,注销情形主要是企业申请、已依法吊销GMP证与已撤销药品批文。
值得注意的是,这85个药品中有19个是长春长生的产品,因已依法吊销GMP证及已撤销药品批文而被注销批文。
此外,有53个药品注销药品文号是企业申请,有业内人士表示,部分品种竞争激烈或企业退出市场或是企业主动申请注销药品批文的原因。
由于无力继续生产,除不得不主动申请注销药品批文外,还有不少药企选择在一些中间平台将手上的批文进行转让。
大批药品批文注销
有数据显示,2016年,我国药监局药品批文超过18万条,截至2018年6月,我国药品批文刚过17万条(国产药品165989条,进口批文4166条),12000多条药品批文消失。
根据现行《药品注册管理办法》,注销药品批准证明文件一共分为六种情况:
1.批准证明文件的有效期未满,申请人自行提出注销药品批准文号的;
2.按照本办法第一百二十六条的规定不予再注册的;
3.《药品生产许可证》被依法吊销或者缴销的;
4.按照《药品管理法》第四十二条和《药品管理法实施条例》第四十一条的规定,对不良反应大或者其他原因危害人体健康的药品,撤销批准证明文件的;
5.依法作出撤销药品批准证明文件的行政处罚决定的;
6.其他依法应当撤销或者撤回药品批准证明文件的情形。
多因素导致药品退市
除上面提到的情况外,一般来说,药品批文注销还有下面这些原因:
过有效期
药品批文过了相应有效期,企业没有及时的再次注册。在我国,药品批文的有效期一般为5年,而后需要再次注册,否则会被注销。
限抗
国家这几年加大了限抗令的执行力度。因此与之相关的全身抗感染、大输液(血液和造血系统用药)类的品种批文有所减少。
比如,日前,国家卫生健康委员会印发《关于持续做好抗菌药物临床应用管理有关工作的通知》(以下简称《通知》)。
《通知》明确要将耐药率高、不良反应多、循证医学证据不足、违规使用突出的药品,清退出供应目录;并进一步抢强调“能口服不肌注,能肌注不输液”的原则,要求各地根据抗菌药物使用监测结果,采取针对性措施,减少不合理的预防性使用和静脉输注抗菌药物。
由于限抗令的影响,消失的批文主要集中在全身抗感染、消化、血液和造血系统,比如葡萄糖注射液、氯化钠注射液、氧和葡萄糖氯化钠注射液均有不少批文消失。
企业主动申请
大多企业都是生产和销售少数几个主打品种,大部分批文是闲置的,有一些十分老旧的、竞争厂家众多的、而本企业多年不生产和销售的品种企业也会主动申请注销批件节省批文维护成本。
据西安交通大学药物分析博士何旭撰文分析,随着制药工艺的不断发展,药品新老剂型更迭,再加上临床治疗方案的不断推陈出新,一些老药自然停用。
比如默克雪兰诺相关人士向媒体透露,退出中国市场的原因,是因为近年来思真在全球范围内已经逐渐使用其他剂型,传统的粉针剂型将停止生产,从而也选择退出中国市场。
监控辅助用药
辅助用药管理已成风雨欲来的势头。去年12月,国家卫健委发布通知,明确将制定全国辅助用药目录和各省辅助用药目录,并要求各地将辅助用药按年度使用金额由多到少排序,选前20位个品种上报目录。
近日,江西、重庆、福建、河北等地区已经先后发布重点监控药品管理办法,这些办法几乎都规定,进入目录的药品,最严将面临停用。
比如福建就明确,生产、配送企业对纳入重点监控清单的药品采购使用异常整改不力或拒绝整改的,视情予以暂停相关药品货款支付、暂停挂网、撤销挂网等处理。
被重点监控的辅助用药注销药品批文有过不少先例,如意大利某公司申请注销注射用还原型谷胱甘肽钠,该药属于抗肿瘤辅助用药,曾进入过部分医院的重点监控用药目录,目前国内仅剩几个药企生产。
清理“僵尸批文”
国家对于过度重复的药品批文加强监控和监管,大量品种批文过度,重复品种再申报收紧,“僵尸批文”面临清理。
根据2018年年初CFDA发布的《总局关于发布第三批过度重复药品提示信息的公告(2018年第16号)》,我国同一品种批文数超过20个的品种有近300个。
其中,将企业近三年无生产和销售的批文称之为“僵尸批文”,据赛柏蓝撰稿作者整理发现,僵尸批文数量超过400条的品种有40个,超过800条的品种有8个,超过1000条的品种有4个。
药品质量问题
何旭还分析到,任何一个药品一旦获得了批准文号后,其各个生产流程都必须固定并且在国家食药监局,一旦有任何变化,就必须向药监总局报告,并获得批准允许后方可再投入生产。
私自更改工艺就可能对药品质量存在影响,生产出的药品也属于假药,是不允许上市销售的,同时企业将会被吊销许可证一旦药品被吊销许可证,其拥有的药品批文也会被注销。
除以上原因外,药品安全问题、一致性评价政策等也是不少药品批文注销的原因。
附:被注销的药品批文
责任编辑:露儿
-
一批药被查 涉维C银翘片、阿胶…
一批药被查 涉维C银翘片、阿胶…...
-
高值耗材最高降价80% 涉雅培、波科、贝朗…
8月1日,云南省曲靖市举行高值医用耗材联盟带量集中采购第一批次中选产品企业签约仪式。...
-
国家指令 整治所有医院回扣 暗访组出发
日前,国家卫健委发布了《2020年医疗行业作风建设工作专项行动方案》,这次方案的重点就是规范医疗机构及其从业人员行为,印发给各省、自治区、直辖市及新疆生产建设兵团卫生健康委,开始组织实施。...
-
医药代表系统学习产品知识的十个步骤
每个刚入行的医药代表初期都会接受公司大量培训,产品知识培训更是重中之重,不仅培训而且还要考试。...
-
“3+6”医用耗材带量采购,价格信息公布
吉林省政府采购中心消息发布《京津冀及黑吉辽蒙晋鲁医用耗材(人工晶体类)联合带量采购文件(LH-HD2020-1)》(下称《采购文件》),公布人工晶体类耗材的具体采购品种、申报价格等信息。 ...
-
首轮价格降幅低于42% 医疗器械企业直接淘汰
首轮价格降幅低于42% 医疗器械企业直接淘汰...
-
Q1最惨淡的两大药品领域,代表都离职了!
中国虽然是世界上最先控制住疫情的国家,但随着全球疫情的爆发,输入病例不断上升,加上中国本土还有不少无症状感染患者,这使得中国经济无法完全恢复正常。...
-
某些药企又要开启新一轮裁员了
做代表难,今年更加难。除了国家级的带量采购,省级也有带量采购,感觉就像是夹缝中求生存。...
-
两家外企大裁员,患教专员全部解散!
两家外企大裁员,患教专员全部解散!...
-
执业药师挂证,面临终生逐出行业的巨大风险
执业药师挂证,面临终生逐出行业的巨大风险...
-
虚开发票2.5亿,涉多家药械企业(附目录)
近日,国家税务总局马鞍山市税务局发布的《重大税收违法案件信息公告2020年3月》显示,51家企业涉嫌虚开发票,其中24家是药械企业或相关资讯、服务企业。...
-
91家药企收入公开:以岭、科伦、康恩贝…
突如其来的新冠肺炎疫情,对中国的冲击力和冲击面都超过了2003年的非典,对中国经济乃至世界经济也产生了不可避免的影响,也严重扰乱了正常的经济运行节奏。...





















