46款新药创20年新高!2017年FDA获批新药汇总
2017年FDA共计批准了46个新分子实体(new molecular entity , NME),其中包含34个NDA,12个BLA。相较于2016年,2017年毫无疑问是一个"丰收年",新药上市数量刷新20年纪录,创历史新高。
美国CDER 1997-2017年批准的新药数量
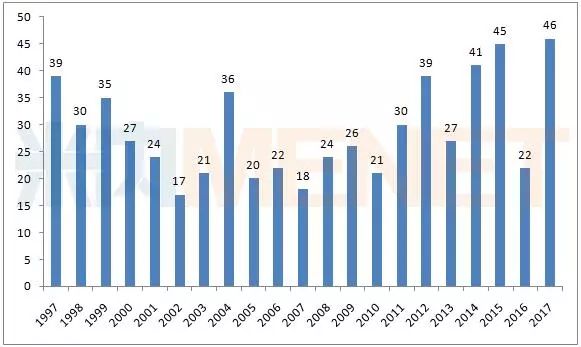
数据来源:米内网综合整理
18款孤儿药,罕见病新药硕果累累
2017年FDA批准的46款新药汇总
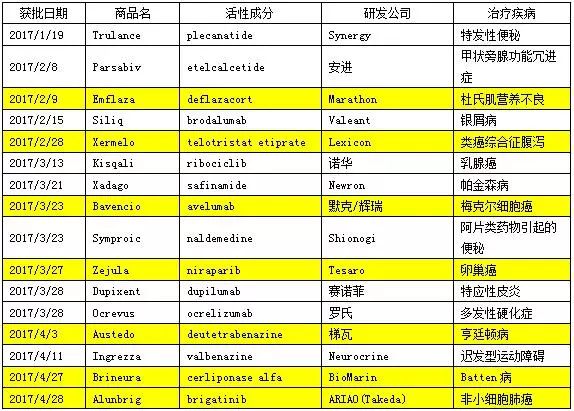
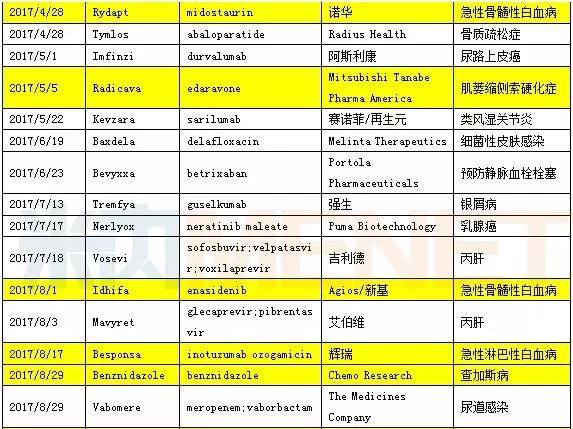
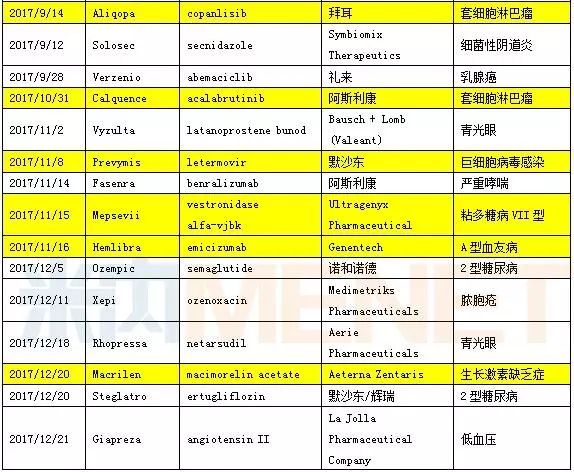
数据来源:米内网综合整理,表中标黄的为孤儿药
孤儿药的适应症患者数量非常的少,也许少到千人甚至仅有几百人,例如粘多糖病VII型患者全球仅有不到150名患者。FDA一直致力于孤儿药创新药的加速批准,给孤儿药的审批开通绿色通道。数据显示,2017年总计18款药物属于孤儿药,为历年最多。孤儿药的开发一直是国内企业的短板,虽然国家相关部门颁布了多项鼓励政策,但诸如开发难度大、成本高以及适用人群少导致利润过低等问题,极大地限制了国内孤儿药的发展。
13款抗癌新药,肿瘤领域依旧最火
2017年FDA批准的46款新药治疗领域分布
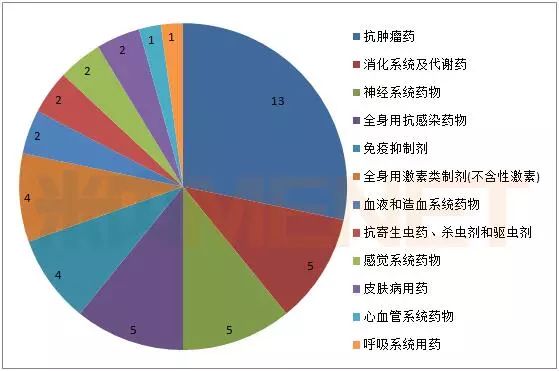
数据来源:米内网综合整理
从治疗领域来看,抗肿瘤新药依旧是2017新药产出大类,占全年新药数量近30%。相比之下,心血管系统药物、呼吸系统用药这两个曾经诞生过众多重磅炸弹药物的板块早已热度不在。
最值得关注的5款重磅“炸弹”药物
5款重磅“炸弹”药物
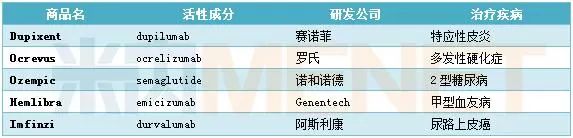
特应性皮炎用药:$50亿重磅新药Dupixent
Dupixent研发情况

(点击查看大图)
数据来源:米内网全球药物研发库
Dupixent(dupilumab)是一种IL-4Rα亚基抑制剂,2017年3月28日获批用于特应性皮炎的治疗。特应性皮炎是一种发病率极高的疾病,在世界范围内终身发病率高达8-18%,潜在的市场容量巨大。Dupixent临床表现非常优秀,众多市场分析师对其相当看好,预计未来五年的销售额峰值能接近50亿美元。而其最大的竞争对手莫过于辉瑞的Eucrisa,Eucrisa是FDA 15年来第一个特异性皮炎新药,于2016年12月14日获批上市,预计未来五年销售额峰值20亿美元。
多发性硬化症患者的福音:$40亿重磅新药Ocrevus
Ocrevus研发情况
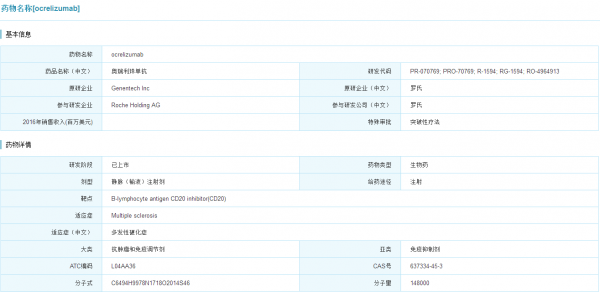
(点击查看大图)
数据来源:米内网全球药物研发库
Ocrevus(ocrelizumab)于2017年3月28日获得FDA批准,是MS领域第一个也是目前唯一一个获得FDA突破性疗法的药物,适应症为复发缓解型的多发性硬化以及原发进展型多发性硬化。Ocrevus是一种CD20抗体,是一种全新靶点的药物。根据公布的临床试验数据显示,Ocrevus的、安全性和耐受性良好,同时治疗效果显著,是首个被证实用于原发进展性硬化症有效的药物,预计未来五年销售额峰值能达到40亿美元。
终极GLP-1制剂:$35重磅新药 Ozempic
Ozempic研发情况
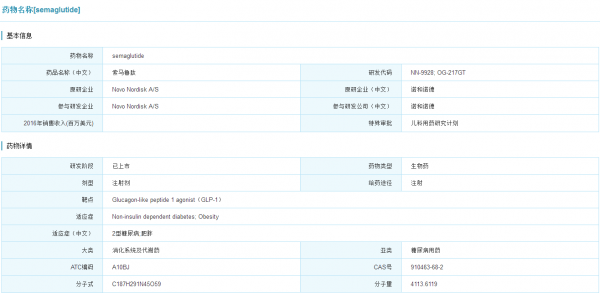
(点击查看大图)
数据来源:米内网全球药物研发库
Ozempic(semaglutide)于2017年12月6日获得美国FDA批准上市,由诺和诺德研发,被誉为全球最好的GLP-1激动剂。在诺和诺德公布的SUSTAIN临床项目(由8项临床三期试验组成)的数据结果中,我们可以明显地看出其在降糖、减肥领域的巨大优势。从SUSTAIN 1~5研究的事后分析结果显示,索马鲁肽的降糖和减重效果明显优于安慰剂、西格列汀、甘精胰岛素U100或长效艾塞那肽。从SUSTAIN 7研究的结果显示,索马鲁肽的降糖、减重效果均优于目前市场上表现最好的GLP-1降糖新药度拉糖肽。在减重方面,索马鲁肽也表现出了比减肥药Saxenda(利拉鲁肽)更好的效果(15% vs 10%)。
同时索马鲁肽也是继恩格列净、利拉鲁肽之后,第三个显示具有心血管获益的降糖药。最后,在安全性方面索马鲁肽跟利拉鲁肽、度拉糖肽类似,不良反应可随时间消失。此外,索马鲁肽的口服剂型正处于临床三期,预计能在2019年之前获批。索马鲁肽将是未来数年诺和诺德的业务支柱和增长驱动,有分析师预测其未来五年销售峰值能达到35亿美元。
20年来首个血友病重磅新药:$30亿Hemlibra
Hemlibra研发情况
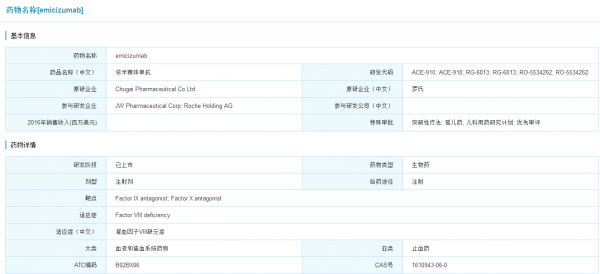
数据来源:米内网全球药物研发库
Hemlibra(emicizumab)由中外制药开发(罗氏子公司),于2017年11月16日获得美国FDA批准上市,商品名为Hemlibra,用于A型血友病患者的治疗。Hemlibra是双特异性因子IXa和因子X定向抗体,它可以将激活天然凝血级联所需的蛋白质因子IXa和因子X聚集在一起,恢复A型血友病患者的凝血过程。Hemlibra是20年来首个血友病新药,是该领域的重大突破。A型血友病影响全球大约32万人,其中50%-60%的人具有该病的严重形式,这一患者群体还有巨大的医疗需求未被满足。Hemlibra的出现给A型血友病带来了更多的希望,业内人士也对其市场前景相当看好,预计未来五年市场销售额峰值能达到30亿美元。
全球第五款PD-1/PD-L1制剂:$25重磅新药Imfinzi
Imfinzi研发情况
(点击查看大图)
数据来源:米内网全球药物研发库
Imfinzi (durvalumab)在2017年5月1日获得FDA批准,由阿斯利康开发,用于治疗晚期或转移性尿路上皮癌,是全球第五款第五款PD-1/PD-L1制剂。除被批准的膀胱癌适应症,该药物还有超过20个临床研究项目正在进行中,适应症几乎涵盖了所有的常见的肿瘤,预计该药未来五年销售峰值将达到25亿美元。
结语2017年是美国FDA丰收的一年,在这12个月中,生物技术与医药行业充满着别样的活力,喜讯不断。在被批准的46款新药中,大约有三分之一的新药有潜力成为重磅“炸弹”药物,批准快速的同时又保证了高质量的审批水平。不断学习、不断进步,相信随着国内企业的不断发展以及政府部门的各种改革,在未来的某一天,我们也能在新药研发领域取得举足轻重的地位。
(沧海月莹)
责任编辑:露儿
-
医院新规:查医药代表 挂钩产品
大医院严查医械代表再升级!私下接触医务人员,直接停止采购公司代理产品。...
-
编外人员被收保证金?医院取消编制大势所趋
看到一家县级医院向编外人员收取5000元工作保证金,限时不交清者,医院不再使用,老徐认为:编制制度或早已不适应医院发展需要了。...
-
三甲医院:8个药询价 要求至少稳定供货半年
三甲医院:供货不稳定,踢出一年。...
-
5省497名执业药师挂证被查实
今年“3•15”后,执业药师“挂证”问题引起全社会关注,按照国家药监局要求,自2019年5月1日起,各省级局组织对行政区域内的药品零售企业开展监督检查。...
-
又一大药陷入致癌风波 多家外企全球召回产品!
一些雷尼替丁药物又被查实含有NDMA杂质,目前山德士、葛兰素史克、印度瑞迪博士药厂均已停止雷尼替丁的供应并召回!...
-
大洗牌!国务院检查组,进入医疗器械企业了
国家严惩在医疗器械购买、销售、纳税...等多个环节的违规情况。...
-
4+7全国扩围,中标结果流出
大跌眼镜!4+7全国扩围结果出炉,有外企低价入围,部分原中选药企落标,多个品种再次刷新底价!...
-
国务院发文:医械行业,筛选重点企业监管
当监管方式越来越科学,不合规或打擦边球的械企面临的压力就越来越大。...
-
报告显示:多数医生不再愿意接待医药代表
报告显示,医生不再愿意接待医药代表,医药代表的必要性在降低。...
-
750家医药企业,最新离职率公布
2019年1月到6月的市场薪酬数据白名单公布,其中医药行业的行业增长和薪酬增长都维持稳定的高位;此外,报告采集了750家医药公司的数据,医药人的平均离职率仅为5.91%,为所有行业中最低的。...
-
63个药,底价曝光(附名单)
(9月6日),山东省药品集中采购网发布《关于山东省药品集中采购拟备案采购产品最低外省及拟挂网价格公示的通知》(以下简称《通知》)。...
-
医药业平均月薪公布 仍是最好的就业去向之一
据东方财富Choice数据,医药行业平均月薪为1.03万,同比涨幅较大,为11.75%,仅次于公用事业等行业,排名第六名。...