一颗药成本5美分,但是卖500美元
核心提示:一颗药成本只要5美分,但是为什么要卖500美元呢?因为那是第二课的价格,第一课的成本是50亿美元!!!
一颗药成本只要5美分,但是为什么要卖500美元呢?因为那是第二课的价格,第一课的成本是50亿美元!!!
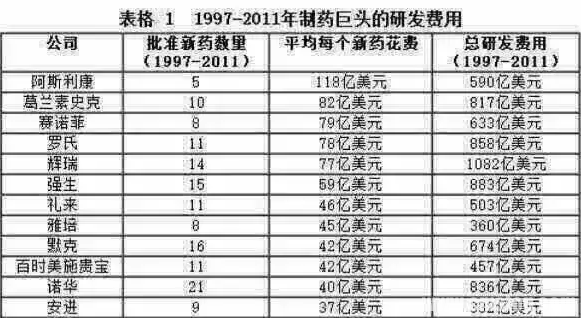
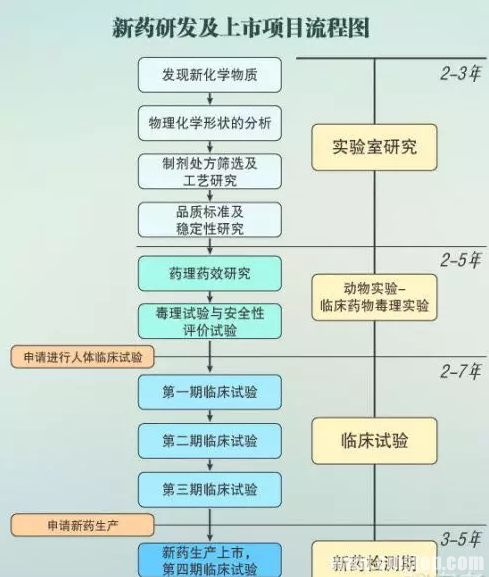
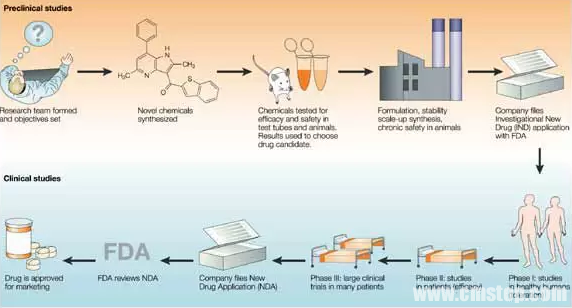
一种新药,25亿美元
现在,研发新药的道路已经变得越来越艰难。从寻找新的备选化合物,到层层试验审批,往往要花去十几年时间和大量的金钱,这其中还有很多努力最终会以失败告终。平均要花多少钱才能得到一个成功上市的新药?根据塔夫茨药物研发中心(Tufts Center for the Study of Drug Development ,CSDD)最近的报告,这个数字现在已经增长到了25亿美元以上。
该数据分析报告是对2003年数据的更新。为了全面地评估药物研发的成本,来自杜克大学和罗切斯特大学的研究者们将药物的实验室研究及临床研究投入分别进行了计算。他们调查了10家制药公司在临床前研究方面1990~2010年的年花费,并据此估算了每种试验药物的平均临床前研究投入。在临床研究方面,研究者随机选取了在1995~2007年间首次开始临床试验的106种药品,并根据它们的实际支出数据计算了试验药品在每一个临床研究阶段的预期支出。此外,研究人员们还计算了试验药物的“总体临床成功率”(经过临床试验阶段最终获批的可能性),并将资金投入换算到2013年的美元货币。
结果显示,每得到一个成功获批上市的新药,平均需要大约25亿5800万美元的投入,这其中包括13亿9500万美元的直接资金投入,以及同期因研发失败而导致的11亿6300万美元的间接投入。
在2003年塔夫茨药物研发中心发表的数据中,每个上市的新药需要的平均投入为8亿200万美元,这相当于2013年的10亿4400万美元。此次更新的数据与2003年的数据相比上涨了145%。
该报告还指出,在一个药物成功上市之后,仍会有平均3亿1200万美元的投入,用于进一步的评估研究,研究目的包括验证新的适应症、剂型以及剂量等等。因此,在整个上市前后的研发周期当中,一种新药可能一共要消耗掉29亿美元资金。
尽管现在更加高效的药物研发手段不断增多,但药物研发的投入依然呈现高速增长的趋势。研究人员指出,导致药物研发花费更加高昂的原因包括临床研究的复杂程度增加、研究规模增大、临床试验的失败率升高等等。药物研发为何如此困难?
以下文字来自《科学美国人》的专栏作家Ashutosh Jogalekar,他目前供职于美国剑桥市的一家初创制药公司,从事药物研发的工作,专业背景是有机化学和计算化学。
你常听人说药为什么那么贵:制药公司贪婪啦、专利体制啦、政府啦,还有资本主义本身。所有这些都确实推高了药品的价格,但还有一个因素却往往遭到了忽视:药品贵,是因为药物发现的科学很难。而且现在越变越难。其实,在纯科学的层面上,把一种药品从研发弄到上市比把一个人送上月球还要难。这么说并非没有道理。在接下来一系列的文章中,我将介绍新药发现科学的老大难问题,希望借此能让公众进一步了解西药的成本并不总关乎利润与权力,与科学上的无知与困难也有很大关联。
药物发现为什么这么难?
其实,一句话就可以把这篇文章先给讲完:为什么药物发现的科学机制这么难?答案是:生物学非常复杂。其次,我们面对的是一个经典的多变量优化问题,只不过是优化是在一个复杂、无法预测且我们对其理解极为有限的系统中进行。就像叫你在一片漆黑中找出一只黑猫,但是你的一只腿被绑在了你的脑袋上,而且你必须在三步之内找到它。
展开来具体说会更有意思。一个简单的事实是,人类仍未弄清楚生物系统——在这里,也即人体——的运行机制,我们还没有办法理性地、有先见地运用有机小分子修正、调节或治愈疾病。目前在对抗疾病方面所取得的成果只能说明人类智慧的伟大和纯粹运气好。前面还有很长的路要走;真正有药物应对且用药次次有效还不产生副作用的疾病少之又少。癌症和老年痴呆症等大多数疾病都还没有医疗解决方案,纵使生物、化学和医学在这一百年来有了长足的进展,很多疾病仍然无药可医。
研究人员只能努力尝试,笨拙地依靠爱迪生那样试了错、错了再试的方法,经过99次失败后换来最后那一次的成功。进入临床试验的新药中大约95%都会被淘汰,常见的原因是疗效不明显以及不可接受的副作用。你也会发现,这些变量在一开始很难预计。难怪发现一种新药这么昂贵了。
原因1:找到“元凶”蛋白质很难
要弄清楚药品设计师所面临的困难,理解药物工作的基础原理是很重要的。几乎所有的西药都是所谓的“小分子”,也即有机小分子化合物,比如阿司匹林,它的分子就仅由几十个原子、化学键和像苯环那样的环组成。最近制药界又再次兴起了抗生素那样的“大分子”,但这里我们还是集中谈小分子。简单来说,西药工作的原理就是与蛋白质结合并调节其功能。蛋白质是生物系统的劳动力,从生长、修复到应激和防御,每一项重要的生理机能都是蛋白质在执行;从发动一项免疫应激到想出一条创意,随便举一项生理过程,都有一些关键的蛋白质在发挥效用。因此,要保持健康,就必须保持体内成千上万种蛋白质之间的精妙平衡,而一旦打破这个平衡疾病就会产生。虽然从理论上讲,在疾病中人体内的整个蛋白质网络都会遭受这样或那样的影响,但幸运的是,对药物设计师而言,只要关注几种起到重要作用的关键蛋白质就行了。
取决于疾病的不同,蛋白质紊乱的方式也可能不同。例如说,癌症就是与细胞生长有关的蛋白质产生过多造成的,同时也有可能抑制细胞生长的蛋白质产生得过少。出现这种情况最常见的原因是蛋白质结构的突变。实际上,特定蛋白质的产生过多是大部分疾病都有的一个常见决定因素。解决方案听起来非常简单:找到一种能与这种蛋白质结合并抑制其作用的小分子,用药物发现的行话来说就是找到药物的“靶向分子”。
而这就是麻烦开始的地方。首先,要找到某种疾病的靶标蛋白质需要大量艰苦卓绝的生化和遗传试验。药物在临床试验失败的一个主要原因就是被靶向攻击的蛋白质其实对这种疾病并没有那么大的贡献,尤其是对大面积人群而言。有几种方法可以测探某种蛋白质和某种疾病状态的相关性。有时候从人口自然遗传实验中会出现偶然的线索,研究人员能够观察到偶然发生的蛋白质突变的作用。举例来说,心脏病靶向药物研究的一个新热点是一种叫做PCSK9的蛋白质,其发现缘于美国德克萨斯州的一名年轻的体操教练,其身上的一种蛋白质变异使其胆固醇水平极其低。但这样的情况十分罕见,更多的是科学家不得不用遗传工程的方法人工使某种蛋白质失效,从而弄清楚这种蛋白质对特定疾病是否有所贡献。
原因2:给蛋白质“下药”很难
但是,就算确定了一种蛋白质是一种疾病的主要影响因素,也不是每种蛋白质都能与某种人工合成的小分子结合并受其调节,因为演化就没有让蛋白质这样过。举个例子,心脏病药物立普妥(阿托伐他汀钙)与一种叫HMG-CoA还原酶的蛋白质结合并抑制其功能,HMG-CoA还原酶是胆固醇合成初期的一种关键蛋白质。胆固醇是生物体内最重要的结构和信号分子之一,而制造胆固醇的基因也好、产品线也罢,都是演化在几亿年以前就组装好了,自然选择没有理由将HMG-CoA还原酶加工成具有容易跟一亿年以后市面上出现的一种热卖药品相结合的性质。但是,我们在化学家和大自然的天才之下,拥有了一种在心脏疾病史上最重要的药物。
HMG-CoA还原酶能抑制胆固醇,而胆固醇能被抑制的事实也证明了它的“可药性”。其他的很多蛋白质很难被抑制,也因此被视为“不可药的”,数十年来试图“药”它们的尝试都失败了。一个绝好的例子就是一种被称为Ras的蛋白质,五例癌症中就有一例涉及了Ras的突变。上面说的PCSK9也是最近才发现“可药”的。人们普遍认为,药物发现越来越难,是因为大部分可药的蛋白质在上世纪八九十年代就被取走了,也即新药见少的“低悬果子”理论。蛋白质不可药的潜在原因有很多,但最重要的一个是:可药的蛋白质都有着很深、很小、结构很好的囊,正好可以容下一个小分子,就像锁容下钥匙。另一方面,不可药的蛋白质表面是大片坑坑洼洼的浅滩,一个小分子要想与之结合,就像攀岩者要在一大块岩壁上寻找落脚点一样困难。但是需要记住一点,将来的制药技术很有可能攻克不可药蛋白质的设计。被证实对疾病有很大贡献且可药的蛋白质被称为“靶标”,也是药物发现产业大举研究且成果颇丰的对象。
无论在哪种情况下,药物发现首先要面对的问题就是,纵使一种蛋白质已经被确定对某种疾病有贡献,但它很可能是不可药的。此外,就算成功对那种蛋白质用了药,涉及这种疾病的其他蛋白质很可能会过量产生,从而抵消抑制第一种蛋白质被抑制的效果。癌症用药当中常常发生这样的情况,也因此癌症患者往往会对某种药物产生抗药性。抗生素也常常如此,细菌会分泌出另一种致病蛋白质从而抵消被抑制的那种,有时候细菌还能分泌专门破坏药物分子的蛋白质。现阶段而言,我们还完全没有能力预测这样的后续反应,因此新药物的发现有很大一部分要靠运气。
责任编辑:露儿
-
医院新规:查医药代表 挂钩产品
大医院严查医械代表再升级!私下接触医务人员,直接停止采购公司代理产品。...
-
编外人员被收保证金?医院取消编制大势所趋
看到一家县级医院向编外人员收取5000元工作保证金,限时不交清者,医院不再使用,老徐认为:编制制度或早已不适应医院发展需要了。...
-
三甲医院:8个药询价 要求至少稳定供货半年
三甲医院:供货不稳定,踢出一年。...
-
5省497名执业药师挂证被查实
今年“3•15”后,执业药师“挂证”问题引起全社会关注,按照国家药监局要求,自2019年5月1日起,各省级局组织对行政区域内的药品零售企业开展监督检查。...
-
又一大药陷入致癌风波 多家外企全球召回产品!
一些雷尼替丁药物又被查实含有NDMA杂质,目前山德士、葛兰素史克、印度瑞迪博士药厂均已停止雷尼替丁的供应并召回!...
-
大洗牌!国务院检查组,进入医疗器械企业了
国家严惩在医疗器械购买、销售、纳税...等多个环节的违规情况。...
-
4+7全国扩围,中标结果流出
大跌眼镜!4+7全国扩围结果出炉,有外企低价入围,部分原中选药企落标,多个品种再次刷新底价!...
-
国务院发文:医械行业,筛选重点企业监管
当监管方式越来越科学,不合规或打擦边球的械企面临的压力就越来越大。...
-
报告显示:多数医生不再愿意接待医药代表
报告显示,医生不再愿意接待医药代表,医药代表的必要性在降低。...
-
750家医药企业,最新离职率公布
2019年1月到6月的市场薪酬数据白名单公布,其中医药行业的行业增长和薪酬增长都维持稳定的高位;此外,报告采集了750家医药公司的数据,医药人的平均离职率仅为5.91%,为所有行业中最低的。...
-
63个药,底价曝光(附名单)
(9月6日),山东省药品集中采购网发布《关于山东省药品集中采购拟备案采购产品最低外省及拟挂网价格公示的通知》(以下简称《通知》)。...
-
医药业平均月薪公布 仍是最好的就业去向之一
据东方财富Choice数据,医药行业平均月薪为1.03万,同比涨幅较大,为11.75%,仅次于公用事业等行业,排名第六名。...





















